Neznáma periodická tabuľka 3. časť
Obsah
Posledná epizóda článku o periodickej tabuľke, okrem školskej (zodpovedá názvu celej série). Dnes o zvyčajne prehliadaných skupinách periodickej tabuľky, umelých prvkoch, o ktorých prakticky nič nevieme, a o tom, čo nás čaká v ôsmej perióde.
, dva rady, zvyčajne umiestnené pod tabuľou, sa v škole správajú s dešpektom – učiteľ len spomenie ich existenciu a prejde k iným, „dôležitejším“ prvkom. Úplne neadekvátne pre funkciu, ktorú vykonávajú v modernom svete. urán i plutónium () tvoria základ jadrovej energie: spoľahlivý zdroj v akýchkoľvek klimatických podmienkach (na rozdiel od netradičnej energie), pri správnom použití je bezpečný a ekologický. Lantanoidy sú v súčasnosti strategickou surovinou potrebnou v mnohých vyspelých technológiách, napríklad moderná elektronika by bez lantanoidov neexistovala. Ale aj teraz sú obe skupiny ťažko prelomiteľné kvôli zákonu periodicity.
Problém č. 1: Lantanoidy
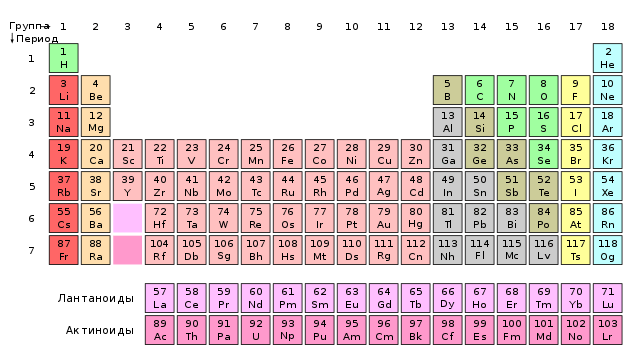
Mendelejev poznal len niekoľko lantanoidov a bez väčších problémov ich dokázal zaradiť do tabuľky (1). V neskorších rokoch však objavy takýchto kovov spochybnili samotný zákon periodicity. Vyžaduje, aby po sebe idúce prvky ležali v susedných skupinách a mali rôzne valencie. Medzitým lantanoidy s mierne odlišnými atómovými hmotnosťami (čo znamenalo, že museli stáť jeden po druhom v súvislom rade) mali vždy valenciu rovnajúcu sa III (niektoré aj II alebo IV), to znamená, že boli v rovnakej skupine. Bolo predložených veľa teórií lantanoidy, napríklad boli všetky považované za rovnaký prvok v rôznych verziách. Problém bol vyriešený umiestnením lantanoidov do jednej „škatule“ systému, ale až kvantová mechanika 20. a 30. rokov vysvetlila ich postavenie v periodickej tabuľke.
1. Cér, najbežnejší lantanoid. Všetky ostatné lantanoidy sú podobné a vyzerajú ako hliník ()
Problém s lantanoidmi je aktuálny aj dnes. V skutočnosti nie je známe, ktorým prvkom začínajú a končia. Podľa väčšiny učebníc lantán, hoci dal meno celej rodine, do nej nepatrí - je škandalózne zo skupiny 3lantanoidy sú kovy od céru po lutécium. Protichodné názory však naznačujú, že posledný člen rodiny skenuje oveľa lepšie. modliť sa. Jeho fyzikálne vlastnosti a chemická povaha výsledných zlúčenín sa lepšie zhodujú s inými prvkami skupiny 3 (lantanoidy sú teda kovy od lantánu po ytterbium). Diskusie medzi chemikmi pokračujú dodnes a autori kníh prezentujú umiestnenie týchto prvkov rôznymi spôsobmi (2).
2. Najdlhší tvar periodickej tabuľky. Lantanoidy a aktinoidy začínajú hneď po skupine 2 a škandleri zahŕňajú lutécium a laureny.
Problém č. 2: aktinidy
aktinidy, teda prvky od aktínia po Laurence, tvoria skupinu podobnú lantanoidom, umiestneným v nasledujúcom období. Problém s aktinoidmi bol a zostáva rovnaký ako s lantanoidmi. Mendelejev poznal iba dva aktinidy a bez problémov ich uviedol v tabuľke (3). Tor s najsilnejšou valenciou sa skupina IV dostala do skupiny titánu a zirkónu a skupina VI s hodnotou urán nachádza sa v spoločnosti chrómu, molybdénu a volfrámu.
Objavy na prelome XNUMX. a XNUMX storočia šokovali systém: objavil sa asi tucet rádioaktívnych prvkov. Niektoré z nich mali rovnaké hmotnosti, ale iné vlastnosti, zatiaľ čo iné mali rovnaké vlastnosti – rôzne hmotnosti. Tento fakt bol v rozpore s predchádzajúcimi poznatkami, no objav izotopov objasnil niektoré problémy. Ukázalo sa, že väčšina prvkov sú zmesi atómov s rôznou hmotnosťou (ale, samozrejme, s rovnakým počtom protónov v jadre). Ak sa vrátime k aktinoidom, dva z nich sa objavili začiatkom minulého storočia. Okamžite sa ukázalo, že aktínium je podobné lantánu (jeho rádioaktivita bola zistená v sedimentoch lantanoidov vyzrážaných z roztokov obsahujúcich aktínium) a protaktínium spadalo do skupiny s vanádom, nióbom a tantalom ako V-hodnotným prvkom. Až do 40. rokov boli prvé štyri aktinidy pokojne umiestnené v skupinách od 3 do 6.
3. Najbežnejšie aktinidy: vľavo je tórium pokryté vrstvou oxidu uhličitého, vpravo urán ()
Problém nastal pri realizácii projektu Manhattan. Fyzici a chemici si boli istí, že vyrobili prvky ťažšie ako uránich prítomnosť však nedokázali zistiť chemickými prostriedkami. Napríklad: prvok 93 vedľa uránu sa nesprával ako člen skupiny 7. Problém vyriešil až návrh Glena Seaborga, neskoršieho objaviteľa niekoľkých transuránových prvkov, že prvky začínajúce aktíniom tvoria rady podobné lantanoidom (4 ). Využitie vyvinutých metód separácie lantanoidov, najmä chromatografia, umožnilo v ďalších rokoch identifikovať umelé prvky. O dokonalosti techniky a šikovnosti experimentátorov svedčí fakt, že prítomnosť niektorých nových prvkov bola objavená len pri desiatke ich atómov! (päť).
Ale neverte, že tórium alebo urán náhle zmenili svoje vlastnosti a stali sa z nich trojmocné kovy podobné lantanoidom. Stále majú viac spoločného s titanidmi a chrómom ako s inými aktinoidmi. Podobne s protaktinátmi a dokonca aj niektorými transuranistami. O istej podobnosti sa môžeme baviť len v druhej polovici série. O lantanoidoch a aktinoidoch však nemožno povedať, že sú príbuzné rodiny (ako keby ich umiestnenie v periodickej tabuľke naznačovalo ich umiestnenie).
4. Glenn Seaborg (1912-99) dáva symbol pre prvok pomenovaný po ňom.
5. Rodiskom mnohých transuranistov je cyklotrón v Národnom laboratóriu Lawrence Berkeley (august 1939)
Žiadne experimentálne údaje
Nepresné znalosti o vlastnostiach najťažších transuranidov sú spojené s nedostatočným množstvom materiálu na výskum. Posledným prvkom, ktorý sa vyrába v pozoruhodnom množstve miligramov, je einstein, ktorý je v tabuľke na 99. mieste. Samozrejme, experimentujú sa aj s inými transuranidmi, ale v ich prípade sa napríklad študuje charakteristické žiarenie vznikajúce v zrazenine a nepozoruje sa tvorba kryštálov zlúčenín.
Fyzikálno-chemické vlastnosti nemožno jednoducho merať, ale len odhadovať z nepriamych pozorovaní. Podobný problém nastáva pri dvoch ľahších prvkoch: astatu (č. 85) i francúzsky (č. 87). Pre ich krátku životnosť sa ešte nepodarilo získať viditeľné veličiny a teória musí vyplniť medzery v pozorovaniach a meraniach. Na druhej strane, ročná produkcia plutónia, ktoré sa v stopových množstvách nachádza v zemskej kôre, je niekoľko ton a je lepšie pochopiteľné ako mnohé ľahšie perzistentné prvky.
Ešte väčší problém je s najťažšími prvkami s periódou 7 po aktinoidoch. V ich prípade sa musí pracovať s doslova oddelenými atómami, ktorých životnosť sa počíta v zlomkoch sekundy. Už nie je možné určiť rádioaktivitu prítomnú v zrazenine zlúčeniny naviazanej na prvok, ale len skúmať určité fyzikálne vlastnosti (napríklad rýchlosť usadzovania na danom povrchu) a vyvodiť tak závery o chemickej podobnosti. Samozrejme, pomáha teória, alebo skôr výpočty založené na kvantovej mechanike. Výsledky však nie sú stopercentne spoľahlivé, napríklad podľa istého rozloženia elektrónov na obaloch je popis chemických vlastností ešte ďaleko. Čím viac sa vzďaľujeme od priamych pozorovacích údajov, tým nespoľahlivejší sa stáva záver „Mendelejevovej metódy“ (teda na základe vlastností známych prvkov).
Chemici a fyzici sa snažia predpovedať vlastnosti aj tých najťažších, zatiaľ nezískaných prvkov budúceho obdobia. Prvky 119 a 120 budú mať pravdepodobne vlastnosti, ktoré sa príliš nelíšia od prvkov nad franciom a rádiom (v skupinách 1 a 2 je zmena fyzikálno-chemických vlastností celkom prirodzená). V období 8, podobne ako lantanoidy a aktinidy, bude existovať až 18 veľmi podobných vlastností prvkov g-bloku, ktorými sa vedci ešte nezaoberali.
Výpočty v tomto období naznačujú existenciu prvkov s valenciou do 12. Pravdepodobne bude v sústave prvok 164, pre ťažšie bude jadrový náboj taký veľký, že na ne budú dopadať elektróny a orbitálna rýchlosť by prekročila rýchlosť svetla. Vykonané výpočty nedávajú jednoznačné výsledky, niektoré posúvajú hranice periodickej tabuľky asi o tucet prvkov.
Zákon periodicity v koši?
Po prečítaní článku ste pravdepodobne prišli na to veľké množstvo výnimiek z pravidiel daných v škole vám to dáva právo odpovedať na otázku kladne. Ale nedávajte to príliš rýchlo. Zákon periodicity je formulovaný veľmi všeobecne (vlastnosti sa periodicky opakujú), čo je jeho výhodou aj nevýhodou. Výhodou je, že analýzou polohy prvku v tabuľke zostavenej na základe zákona možno vyvodiť závery o jeho fyzikálnych a chemických vlastnostiach. Nevýhodou, keďže závery sú často nepresné alebo dokonca nepravdivé.
Zákon periodicity funguje dobre v hlavných skupinách (1, 2, 13-18), lepšie v ich horných častiach ako v dolných. Obdobie 3 je dokonalým príkladom: od sodíka po argón sa valencia a chemické vlastnosti pravidelne menia bez akýchkoľvek prekvapení. Vo vedľajších skupinách (3-12) sú už jasne viditeľné odchýlky, ale o problémoch s lantanoidmi a aktinoidmi ste sa dočítali vyššie. Vo všeobecnosti platí, že čím ďalej od začiatku systému, tým menej presne je splnený zákon periodicity.
Takže do koša? Vesmír chemických prvkov a vzťahy, ktoré vytvárajú, sú systémom tak zložitým, že ho ani skvelý Mendelejevov nápad nedokáže úplne zachytiť. Zákon určite treba opraviť a spresniť. Ak porovnáme Mendelejeva s Newtonom (pretože zákon periodicity aj teória gravitácie zorganizovali a vysvetlili veľké kusy sveta okolo nás), môžeme usúdiť, že chemici na svojho Einsteina stále čakajú.
Pozri tiež:

